|
Description:
|
|
Você herdou genes de seus pais, mas seu material genético não é um roteiro fixo. O DNA contém a informação, mas são as marcas epigenéticas — como acetilação, metilação, fosforilação e glicanos adicionados às histonas e ao DNA — que dizem quais genes estão ligados, desligados ou em espera.
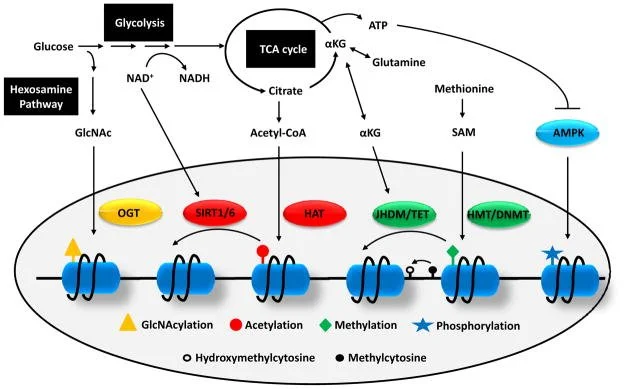
Lu, & Thompson, 2013
O metabolismo da célula — ou seja, a forma como usamos glicose, aminoácidos e lipídios para gerar energia — fornece diretamente os cofatores e substratos usados pelas enzimas epigenéticas. Em outras palavras: os nutrientes que ingerimos e o estado energético da célula se traduzem em marcas químicas que modulam a expressão gênica. Glicose, aminoácidos e o estado energético geram metabólitos-chaves (NAD⁺, acetil-CoA, α-cetoglutarato, SAM, UDP-GlcNAc, ATP) que atuam como substratos ou cofatores de enzimas epigenéticas — por exemplo, sirtuínas, HATs, Jmj/TET, HMT/DNMT, OGT e AMPK. Essas enzimas colocam ou retiram marcas químicas nas histonas (acetilação, metilação, fosforilação, O-GlcNAc) e no DNA (5mC, 5hmC), alterando a acessibilidade da cromatina e, portanto, quais genes são ligados ou desligados. Glicólise / NAD⁺ ⇄ NADH → Sirtuínas (SIRT1/6) Ciclo do TCA → Citrato → Acetil-CoA → HATs (acetilação das histonas) O citrato exportado para citosol/núcleo vira acetil-CoA (via ATP-citrato liase). Acetil-CoA é o doador de grupos acetil: HATs usam-no para acetilar lisinas de histonas, relaxando cromatina e favorecendo transcrição. Alterações na disponibilidade de acetil-CoA linkam estado nutricional ao nível global de acetilação.
Glutamina → α-cetoglutarato (αKG) → Jmj/TET (desmetilases dependentes de αKG) αKG é cofator para as dióxigenases da família Jumonji (remoção de metilas em histonas) e para as enzimas TET (oxidação da 5mC para 5hmC no DNA). A presença de αKG facilita desmetilação; por outro lado, acúmulos de metabólitos análogos (ex.: 2-HG, succinato, fumarato) bloqueiam essas enzimas.
Metionina → SAM (S-adenosilmetionina) → HMTs / DNMTs (transferência de metilas) Via das hexosaminas → UDP-GlcNAc → OGT (O-GlcNAcilação) ATP / AMP → AMPK → fosforilação de histonas/enZimas
Resumindo, nutrição e energia são traduzidas em ‘marcas’ epigenéticas que reprogramam programas transcricionais — com impacto em diferenciação, resposta ao estresse, envelhecimento e câncer. Por que isso importa?Estes processos têm algumas implicações biológicas e clínicas: Plasticidade transcricional: permite que células ajustem programas gênicos de forma rápida e reversível conforme nutrientes/energia. Memória epigenética: mudanças sustentadas (p.ex. metilação do DNA) podem preservar estados celulares induzidos por ambiente/nutrição. Doença e terapia: muitos tumores e distúrbios metabólicos exibem alterações epigenéticas causadas por reprogramação metabólica — e algumas terapias visam esses pontos (inibidores de DNMTs, moduladores de SIRT, etc.). Intervenções (nutrição/estilo de vida): evidências experimentais sugerem que dieta, jejum intermitente e exercício alteram metabólitos epigenéticos; contudo, efeitos em humanos são contextuais e dependem de tecido, dose e duração — cuidado com extrapolações simplistas.
Aprenda mais nos cursos
 Cursos
Cursos
Cursos online na área de nutrição, práticas integrativas e complementares em saúde. https://t21.video |
 More
More
 Religion & Spirituality
Religion & Spirituality Education
Education Arts and Design
Arts and Design Health
Health Fashion & Beauty
Fashion & Beauty Government & Organizations
Government & Organizations Kids & family
Kids & family Music
Music News & Politics
News & Politics Science & Medicine
Science & Medicine Society & Culture
Society & Culture Sports & Recreation
Sports & Recreation TV & Film
TV & Film Technology
Technology Philosophy
Philosophy Storytelling
Storytelling Horror and Paranomal
Horror and Paranomal True Crime
True Crime Leisure
Leisure Travel
Travel Fiction
Fiction Crypto
Crypto Marketing
Marketing History
History

.png)
 Comedy
Comedy Arts
Arts Games & Hobbies
Games & Hobbies Business
Business Motivation
Motivation